Sólidos Cristalinos
Las sustancias se presentan, normalmente, en los estados sólido , líquido y gaseoso. Para una sustancia en estado gaseoso, la distancia media de separación entre las partículas (moléculas o átomos) es grande, comparada a sus diámetros, de modo que la interacción entre ellas puede ser ignorada
Con todo, a temperaturas y presiones usuales, muchas sustancias están en los estados líquidas y sólidas y la interacción entre las correspondientes partículas no puede más ser ignorada.
En esos casos, la distancia de separación entre las partículas es del orden de cantidad de sus diámetros y la intensidad de las fuerzas que las mantienen juntas y del orden de cantidad de intensidad de las fuerzas que ligan los átomos para formar moléculas.
En los sólidos , los átomos (o moléculas) pueden o no existir como entidades aisladas pero, de cualquier modo, sus propiedades son modificadas por los átomos (o moléculas) de las proximidades.
Por ejemplo, los niveles de energía de los electrones mas exteriores de un átomo (o de una molécula) son distorsionados por los átomos (o moléculas) vecinas.
En los sólidos cristalinos, los átomos (o moléculas) ocupan posiciones regularmente distribuidas en el espacio, constituyendo una red regular llamada red cristalina.
La configuración regular puede alcanzar distancias muy grandes.
En los sólidos no cristalinos (amorfos), como el concreto, el asfalto, el vidrio, la cera y el plástico, la configuración regular prevalece apenas en la cercanía de los átomos o moléculas individuales y sobre distancias mayores, prevalece el desorden.
Una base para clasificar los sólidos cristalinos es la naturaleza de las fuerzas que mantienen unidos los átomos (o moléculas) en el ordenamiento de la red cristalina. La energía de cohesión de los átomos (o moléculas) en un cristal, depende de las fuerzas de enlace dominantes entre esos átomos (o moléculas).
El mismo esquema de clasificación que es apropiado para los enlaces moleculares es también útil para los sólidos. Entre tanto, una nueva categoría es necesaria, el enlace metálico. Ese mecanismo, efectivo para el enlace de átomos en metales como el sodio, el cobre, la plata y otros, en las fases sólida y líquida, no produce complejos moleculares en la fase gaseosa.
Los sólidos cristalinos pueden ser iónicos, covalentes, moleculares o metálicos
Sólidos Iónicos
En los sólidos iónicos, la red está formada por iones alternadamente positivos y negativos, resultantes de la transferencia de un electrón (o más) de un tipo de átomo para el otro.
La estabilidad de la red cristalina es mantenida por la atracción electroestática entre los iones presentes, tales como los iones Na+ e Cl- en la molécula NaCl (cloruro de sodio) y los iones Li+ e F- en la molécula LiF (fluoruro de litio).
Como esos sólidos no tienen electrones libres, su conductividad eléctrica es muy baja (son aislantes). Pero, si una cantidad apropiada de energía es provista a un sólido iónico de modo que el se transforme en un líquido, el se vuelve un buen conductor de electricidad.
Los sólidos iónicos son generalmente duros, frágiles y tiene un elevado punto de fusión debido a las fuerzas electroestáticas relativamente intensas entre los iones.
Algunos cristales iónicos absorben radiación electromagnética con longitudes de onda en la región de los mayores longitudes de onda en el infrarrojo, ya que la energía necesaria para producir vibraciones en red cristalina es menor que cerca de 1 eV. La energía para producir tales vibraciones es, en general, más baja, para los cristales ionicos que para los covalentes, en virtud de la energía de enlace ser relativamente mas baja.

Sólidos Covalentes
En los sólidos covalentes no existe transferencia de carga entre los átomos para formar iones, como el caso de los cristales iónicos, pero un compartimiento de pares de electrones de valencia entre los átomos.
La estructura cristalina de un sólido covalente queda definida por la direccionalidad del enlace covalente. Por ejemplo, los átomos tetravalentes de carbono, germanio y silicio forman enlaces covalentes en las combinaciones moleculares.
Cada uno de esos átomos tiene cuatro electrones en la capa electrónica más externa, o sea, tiene cuatro electrones de valencia, cuyos orbitales son orbitales híbridos s-p3.
En el sólido cristalino correspondiente, cada átomo forma enlaces covalentes con los cuatro átomos más próximos, quedando en el centro de un tetraedro regular, con cuatro átomos semejantes en los vértices.
Así, cuatro enlaces covalentes idénticos pueden ser formados, con cada átomo contribuyendo con un electrón a cada una de esos enlaces.
En ese tipo de estructura, organizada por enlaces covalentes, cada electrón está fuertemente enlazado, de modo que no existen electrones libres para participar de cualquier proceso de conducción y los sólidos covalentes tienen una conductivitad eléctrica muy baja (son aislantes)
Además de esto, son extremadamente duros y difíciles de deformar.
Por otro lado, son necesarias energías relativamente altas, del orden de algunos electrón-volts, para producir vibraciones en la red cristalina es como las energías de los fotones asociados a la región visible en el espectro magnético están entre 1,8 y 3,1 eV, muchos sólidos covalentes son incoloros (transparentes).

Sólidos Moleculares
En los sólidos moleculares constituidos por moléculas apolares, los electrones se encuentran emparejados y no pueden formar enlaces covalentes. Las moléculas conservan su individualidad pero están enlazadas por las fuerzas de Van del Waals, las mismas que existen entre las moléculas de un gas o de un líquido.
Las fuerzas de Van der Waals son bastante débiles y son derivadas de la interacción entre dipolos eléctricos. Por el movimiento de los electrones alrededor de los núcleos en una molécula apolar puede suceder que, por un breve instante, la distribución de carga sea tal que parte de la molécula se vuelva positiva en la parte negativa.
En cuanto está polarizada, esta molécula induce en otra molécula de su entorno una distribución de carga semejante y las dos se atraen. En el siguiente instante, las moléculas vuelven a las configuraciones originales y no se atraen más.
Esto se repite aleatoriamente con todos los pares de moléculas del sólido.
Los gases nobles, gases comunes como el oxígeno y el hidrógeno y muchos compuestos orgánicos forman sólidos moleculares de ese tipo.
En algunos sólidos moleculares, las moléculas son pobres, como en el caso del hielo, por ejemplo.
Las moléculas de agua son polares porque, en cada una de ellas, el átomo de oxígeno atrae más cerca de si los electrones que constituyen los enlaces covalentes con los átomos de hidrógeno. Entonces, la parte de una molécula correspondiente al átomo de oxígeno es negativa y las partes correspondientes a los átomos de hidrógeno, positivas.
El enlace entre las moléculas, llamado enlace de hidrógeno, se da por la atracción electroestática entre la parte negativa de una molécula y la positiva de otra.
Los sólidos moleculares tienen una conductividad eléctrica muy baja (son aislantes)

Sólidos Metálicos
Un sólido metálico es formado a partir de átomos con algunos electrones débilmente ligados en las capas más externas, electrones estos que pasan a moverse por todo el sólido cuando de su formación.
Así, un sólido metálico es constituido por una red ordenada de iones positivos que son mantenidos juntos por una especie de gas de electrones libres. La movilidad de los electrones de valencia que constituyen ese gas de electrones libres y que torna los metales buenos conductores de electricidad.

Los tipos de cristales que constituyen un solido cristalino se pueden clasificar en:

Sistema Cristalino Simple
Un sólido cristalino se construye a partir de la repetición en el espacio de una estructura elemental paralelepipédica denominada celda unitaria. En función de los parámetros de red, es decir, de las longitudes de los lados o ejes del paralelepípedo elemental y de los ángulos que forman, se distinguen sietesistemas cristalinos:
| Sistema cristalino | Ejes | Angulos entre ejes |
|---|---|---|
| Cúbico | a = b = c | α = β = γ = 90° |
| Tetragonal | a = b ≠ c | α = β = γ = 90° |
| Ortorrómbico | a ≠ b ≠ c ≠ a | α = β = γ = 90° |
| Hexagonal | a = b ≠ c | α = β = 90°; γ = 120° |
| Trigonal (o Romboédrica) | a = b = c | α = β = γ ≠ 90° |
| Monoclínico | a ≠ b ≠ c ≠ a | α = γ = 90°; β ≠ 90° |
| Triclínico | a ≠ b ≠ c ≠ a | α ≠ β ≠ γ
α, β, γ ≠ 90°
|
En función de las posibles localizaciones de los átomos en la celda unitaria se establecen 14 estructuras cristalinas básicas, las denominadas redes de Bravais.
Elementos de simetría
El tipo de sistema normal cristalino depende de la disposición simétrica y repetitiva de las caras que forman el cristal. Dicha disposición es consecuencia del ordenamiento interno de sus átomos y, por lo tanto, característico de cada mineral. Las caras se dispondrán según los elementos de simetría que tenga ese sistema, siendo uno de ellos característico de cada uno de los siete sistemas:
| Sistema cristalino | Elementos característicos |
|---|---|
| Cúbico | Cuatro ejes ternarios |
| Tetragonal | Un eje cuaternario (o binario derivado) |
| Ortorrómbico | Tres ejes binarios o tres planos de simetría |
| Hexagonal | Un eje senario (o ternario derivado) |
| Trigonal (o Romboédrica) | Un eje ternario |
| Monoclínico | Un eje binario o un plano de simetría |
| Triclínico | Un centro de simetría o bien ninguna simetría |


celda unitaria, la porción más simple de la estructura cristalina que al repetirse mediante traslación reproduce todo el cristal. Todos los materiales cristalinos adoptan una distribución regular de átomos o iones en el espacio.Se trata de un arreglo espacial de átomos que se repite en el espacio tridimensional definiendo la estructura del cristal. Se caracteriza por tres vectores que definen las tres direcciones independientes del sistema de coordenadas de la celda. Esto se traduce en seis parámetros de red, que son los módulos, 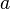 ,
,  y
y  , de los tres vectores, y los ángulos
, de los tres vectores, y los ángulos  ,
, 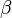 y
y 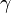 que forman entre sí. Estos tres vectores forman una base del espacio tridimensional, de tal manera que las coordenadas de cada uno de los puntos de la red se pueden obtener a partir de ellos por combinación lineal con los coeficientes enteros.La posición de un átomo dentro de la celda unidad se describe normalmente usando coordenadas fraccionarias. Lasimetría traslacional de una estructura cristalina se caracteriza mediante la red de Bravais, existen 14 redes de Bravais diferentes y todas las estructuras cristalinas minerales conocidas encajan en una de esas 14 disposiciones. Estas redes pueden ser:
que forman entre sí. Estos tres vectores forman una base del espacio tridimensional, de tal manera que las coordenadas de cada uno de los puntos de la red se pueden obtener a partir de ellos por combinación lineal con los coeficientes enteros.La posición de un átomo dentro de la celda unidad se describe normalmente usando coordenadas fraccionarias. Lasimetría traslacional de una estructura cristalina se caracteriza mediante la red de Bravais, existen 14 redes de Bravais diferentes y todas las estructuras cristalinas minerales conocidas encajan en una de esas 14 disposiciones. Estas redes pueden ser:
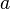 ,
,  y
y  , de los tres vectores, y los ángulos
, de los tres vectores, y los ángulos  ,
, 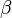 y
y 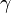 que forman entre sí. Estos tres vectores forman una base del espacio tridimensional, de tal manera que las coordenadas de cada uno de los puntos de la red se pueden obtener a partir de ellos por combinación lineal con los coeficientes enteros.La posición de un átomo dentro de la celda unidad se describe normalmente usando coordenadas fraccionarias. Lasimetría traslacional de una estructura cristalina se caracteriza mediante la red de Bravais, existen 14 redes de Bravais diferentes y todas las estructuras cristalinas minerales conocidas encajan en una de esas 14 disposiciones. Estas redes pueden ser:
que forman entre sí. Estos tres vectores forman una base del espacio tridimensional, de tal manera que las coordenadas de cada uno de los puntos de la red se pueden obtener a partir de ellos por combinación lineal con los coeficientes enteros.La posición de un átomo dentro de la celda unidad se describe normalmente usando coordenadas fraccionarias. Lasimetría traslacional de una estructura cristalina se caracteriza mediante la red de Bravais, existen 14 redes de Bravais diferentes y todas las estructuras cristalinas minerales conocidas encajan en una de esas 14 disposiciones. Estas redes pueden ser:- Tipo P: Se denomina primitiva y tiene puntos de red en los vértices de la celda.
- Tipo I: Red centrada en el interior. Esta presenta puntos de red en los vértices de la celda y en el centro de la celda.
- Tipo F: Red centrada en todas las caras. Presenta puntos de red en los centros de todas las caras, así como en los vértices.
- Tipo C: Red centrada en la base. Una red tipo C se refiere al caso en el que la simetría traslacional coloca puntos de red en los centros de las caras delimitados por las direcciones a y b así como en el origen.Además de la simetría traslacional descrita en una red cristalina existen elementos de simetría. Estos elementos son:
- Centro de inversión.
- Plano de reflexión.
- Ejes de rotación de orden 2, 3, 4 y 6.
- Ejes de rotación-inversión de orden 3, 4 y 6.
Los elementos de simetría anteriores pueden coexistir en una estructura cristalina dando lugar a lo que se conoce comogrupo puntual de simetría. Existen 32 grupos puntuales de simetría y el nombre alude a que las operaciones asociadas forman un grupo matemático y los elementos tienen un punto en común que no se mueve al realizar las operaciones.Cuando se acoplan traslación con los ejes de rotación y planos de simetría surgen nuevos elementos de simetría: ejes helicoidales y planos de deslizamiento.Cuando se combinan los 32 grupos puntuales de simetría con los elementos de simetría traslacional y las 14 redes de Bravais se obtienen los 230 grupos espaciales de simetría posibles. Estos grupos determinan los tipos y posiciones de los elementos de simetría que son posibles para una estructura cristalina.Los puntos de red que muestran la simetría traslacional de una estructura pueden ser conectados mediante los planos de red. Cada plano pertenece a un conjunto de planos equiespaciados que contienen todos los puntos de red. Estos planos se nombran usando los índices de Miller. Estos índices se designan convencionalmente h, k, y l, se escriben entre paréntesis (h,k,l) y son enteros positivos, negativos o cero. La separación de los planos se conoce con el término de espaciado dhkl. La relación entre el espaciado d y los parámetros de red puede determinarse geométricamente y depende del sistema cristalino.

Participantes:
Liliana Caceres v-25606982
Osmary Dudamel v-26165033
Elizabeth Quintero v-19573428
Cinthia Colmenarez v-
Maria Aguilar v-25697780
Ingenieria Agroindustrial
Seccion ¨C¨
Prof: Maria Lopez
No hay comentarios:
Publicar un comentario